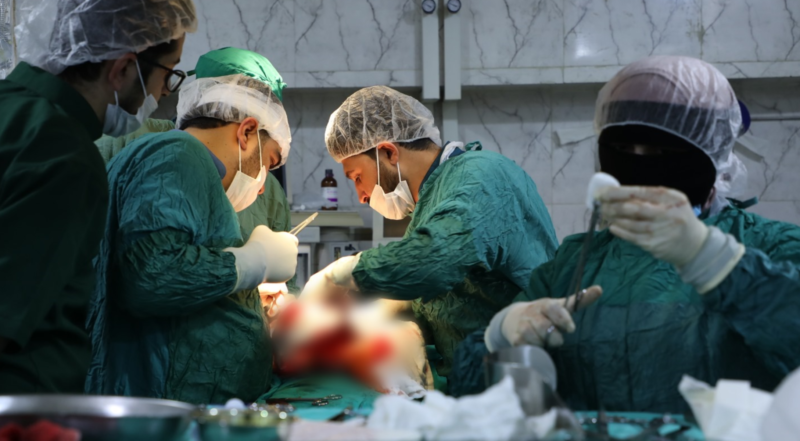
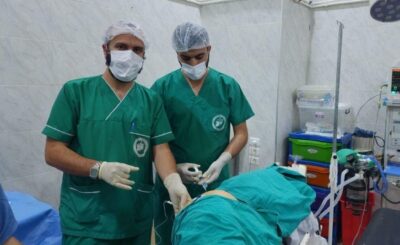
المقدمة:
يُعتبر السرطان الغدي أكثر أنواع الأورام الخبيثة شيوعًا في المعدة، حيث يُشكّل حوالي 95% من أورام المعدة، وتُصنّف السرطانات الغدية إلى نوعين: سرطان الفؤاد وسرطان غير الفؤاد، وذلك بناءً على موقعها التشريحي في المعدة، بينما تمثل اللمفوما، الأورام الكارسينوئيدية، وأورام اللحمة المعدية – المعوية بقية الحالات.(1) على الرغم من أن معدلات الإصابة بسرطان المعدة قد انخفضت بشكل كبير خلال الخمسين عامًا الماضية، إلا أنه لا يزال يشكل تحديًا طبيًا رئيسيًا، خصوصًا في الفئة العمرية بين 60 و80 عامًا، مع احتمالية ظهوره في الأعمار الأصغر سنًا.(2)
نستعرض في هذه الحالة السريرية، تشخيص وعلاج مريض يبلغ من العمر خمسين عامًا تم تشخيصه بسرطانة حلقية في المعدة. شملت الأعراض الرئيسية لدى المريض ألمًا في المنطقة الشرسوفية، فقدان الوزن، والتعب العام. تم التعامل مع الحالة بعد الفحص السريري والاستقصاءات الطبية، من خلال العلاج الكيميائي المبدئي بإشراف طبيب الأورام، ثم تم بعد ذلك إجراء استئصال كامل للمعدة جراحيًا، وخرج المريض من المستشفى بحالة عامة جيدة.
عرض الحالة:
راجعنا مريضًا يبلغ من العمر 48 عامًا يعاني من ألم شرسوفي غير منتشر بدأ قبل 9 أشهر على شكل نوبات، يزداد الألم عند الشعور بالجوع ويخف بعد تناول الطعام. كانت الأعراض مصحوبة بضعف في الشهية وإقياء بعد تناول الأطعمة الدسمة، دون وجود ارتفاع في درجة الحرارة أو تغيّر في عادات التغوط. كما أشار المريض إلى فقدان وزن حوالي 10 كغ في الفترة الأخيرة، ولم تظهر عليه علامات نزف هضمي مثل التغوط الزفتي أو الإقياء المدمى. ليس لدى المريض أي سوابق مرضية.
الفحص السريري:
كانت الحالة العامة للمريض جيدة، مع علامات حيوية مستقرة. فحص الصدر، صافِ ومتناظر، أما البطن فكانت لينة وتتحرك بشكل طبيعي مع التنفس، مما يشير إلى غياب أي علامات على وجود توتر أو شد عضلي.
التقييم التشخيصي، تم النظر في عدة احتمالات لتشخيص الحالة، بما في ذلك القرحة المعدية، سرطان المعدة، والتهاب المعدة. وقد كانت الفحوصات التشخيصية الأولية ضمن الحدود الطبيعية، مما دفع الفريق الطبي إلى استكمال المزيد من الفحوصات للوصول إلى التشخيص النهائي.
الإجراءات التشخيصية:
بعد زيارة المريض للعيادة الهضمية، تم إعطاؤه علاجًا دوائيًا مخصصًا للقرحة المعدية، إلا أن الحالة لم تتحسن. على العكس، بدأت أعراض أخرى بالظهور مثل الإسهال وتجنب تناول الطعام خوفًا من حدوث إقياء أو ألم. بناءً على ذلك، تقرر إجراء تنظير هضمي علوي.
تم إجراء مجموعة من التحاليل المخبرية شملت: تحليل سكر الدم، خمائر الكبد، تحري التهاب الكبد الفيروسي، وظائف الكلى، واختبارات النزف والتخثر، وجاءت جميع النتائج ضمن الحدود الطبيعية.
عند إجراء التنظير الهضمي العلوي، وُجدت كتلة كبيرة متقرحة في المعدة، تقع على الانحناء الصغير وتبدأ مباشرة تحت الفؤاد وتمتد لتغطي معظم هذا الانحناء. تم أخذ عينات متعددة من الكتلة لفحصها نسيجيًا. وأظهرت نتائج التنظير وجود كتلة معدية، مع توصية بإجراء مزيد من فحوصات التشريح المرضي. بالإضافة إلى ذلك، أظهر الفحص التنظيري أن المريء والفتحة البوابية كانا بحالة طبيعية، بينما كانت الكتلة المتقرحة في الجدار الخلفي للمعدة تمتد نحو فتحة البواب وتغلق معظم تجويف المعدة. تم أخذ خزعة بحجم 3 × 3 × 2 ملم، وكان التشخيص النهائي هو سرطانة خلية الحلقة الخاتمية (Signet-ring cell carcinoma) استنادًا إلى الخزعات المأخوذة من جسم المعدة.
التدبير الأولي:
بعد تشخيص المريض بإصابة في المعدة، تم إجراء تصوير طبقي محوري مع حقن المادة الظليلة. أظهر الفحص وجود تسمك متوسط الشدة غير منتظم في منتصف المعدة وفي منطقة الانحناءين، مع تعزيز واضح للمادة الظليلة. نتيجة لهذا التقييم، تم إحالة المريض إلى عيادة الأورام حيث خضع إلى علاج كيميائي، وتلقى 4 جرعات.
بعد العلاج الكيميائي، تقرر إعادة إجراء التنظير الهضمي والتصوير الطبقي المحوري.
أظهر التنظير الهضمي العلوي الثاني وجود قرحة حافرة بحواف مرتفعة قليلاً وهشة، تقع على الوجه الخلفي والانحناء الصغير لجسم المعدة، على بُعد حوالي 2 سم من الوصل المعدي، مع قطر يتراوح بين 2-3 سم وطول 4 سم. كما لوحظ التهاب واحتقان في مخاطية جسم المعدة.
أظهر فحص الطبقي المحوري الثاني أن المعدة والأمعاء في المقاطع المدروسة كانت ضمن الحدود الطبيعية، بدون أي تغييرات مرضية أو شذوذات. وكانت نتائج التصوير الطبقي المحوري للدماغ، العنق، الصدر، والبطن تظهر جميع الأعضاء كانت طبيعية من حيث الشكل والحجم والكثافة، ولم يتم العثور على أي كتل، تكيسات، أو عقد غير طبيعية.
مما يشير إلى أن جميع الأعضاء التي تم فحصها كانت ضمن الحدود الطبيعية، ولم يتم العثور على أي دليل يشير إلى وجود مرض أو مشكلة صحية تُذكر في الدماغ، العنق، الصدر، أو البطن.
التداخل الجراحي:
بعد الفحوصات الأولية وتلقي العلاج الكيميائي، تم التوجه نحو الحل الجراحي للمريض الذي تضمن استئصال معدة تام. خلال الإجراءات التمهيدية للجراحة، تم إجراء تنظير بطن استقصائي للتحقق من احتمال وجود نقائل في البريتوان، حيث تم أخذ خزع من الانزراعات المشتبه بها وعينة من سائل الحبن لفحص التشريح المرضي.
استجابة العلاج ونتائج الجراحة:
كانت الاستجابة للعلاج الكيميائي جيدة، ومكّنت الأطباء من المضي قدمًا بالخطة الجراحية. حيث تم استئصال كامل للمعدة وإرسال الأنسجة المستأصلة لتحليل التشريح المرضي، والذي أكد خلو الحواف الجراحية من السرطان SRCC – حواف جراحية حرة. وبناءً على خزعة البريتوان تم التوصل إلى تشخيص يتوافق مع التهاب بريتواني مزمن غير محدد (Chronic non-specific peritonitis).، حيث كان السائل البريتواني الناتج هو سائل تفاعلي التهابي حميد (Benign inflammatory reactive fluid).، تم تشخيص وجود نقائل في 4 من 12 عقدة لمفية مختبرة، مما يصنف الحالة على أنها بالمرحلة IIIA.
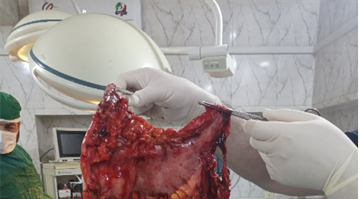
مسار الرعاية بعد الجراحة:
بقي المريض في العناية المركزة لمدة 4 أيام لمراقبة حالته والتأكد من استقرارها. تم نقل المريض إلى جناح الاستشفاء بعد تحسن حالته، حيث تابع التعافي. تم تخريج المريض من المستشفى في اليوم الثامن بعد الجراحة، وكان في حالة صحية جيدة.
النتائج والمتابعة:
المريض بحالة عامة جيدة وبصحة ممتازة
المناقشة حول الجراحة والمعالجة الكيميائية في سرطان المعدة:
سرطان المعدة الغدي، المعروف عادة باسم أدينوكارسينوما adenocarcinoma، هو نوع فرعي مهم من سرطان المعدة ويمثل حوالي 95٪ من جميع حالات سرطان المعدة. ينشأ هذا النوع من السرطان من الخلايا الغدية في بطانة المعدة ويصنف في المقام الأول إلى نوعين تشريحيين: الفؤاد (يقع بالقرب من المريء) وغير الفؤاد (يوجد في الجزء السفلي من المعدة).(1)
في عام 2020، كان هناك ما يقرب من 1.1 مليون حالة جديدة من سرطان المعدة تم تشخيصها على مستوى العالم، مما يجعله خامس أكثر أنواع السرطان شيوعًا والسبب الرابع الرئيسي للوفيات المرتبطة بالسرطان، مع حوالي 800000 حالة وفاة منسوبة إلى هذا المرض. تختلف معدلات الإصابة بشكل كبير حسب المنطقة. على سبيل المثال، أبلغت دول شرق آسيا، وخاصة الصين واليابان، عن بعض أعلى معدلات سرطان المعدة الغدي. في المقابل، تكون المعدلات أقل بكثير في أمريكا الشمالية وشمال أوروبا.(3)
عوامل الخطر الرئيسية تشمل:
- الإصابة بجرثومة الملوية البوابية
- العوامل الغذائية مثل تناول كميات كبيرة من الملح
- عوامل نمط الحياة بما في ذلك التدخين والسمنة
- الوضع الاجتماعي والاقتصادي والتهاب المعدة المزمن.(4)
يعتبر معدل البقاء على قيد الحياة لمدة خمس سنوات لسرطان الغدة المعوية منخفضًا، وغالبًا ما يكون أقل من 20٪، ويرجع ذلك إلى حد كبير إلى التشخيص في مرحلة متأخرة عندما تصبح الأعراض واضحة.
إن فهم هذه الديناميكيات أمر بالغ الأهمية لتطوير استراتيجيات الوقاية المستهدفة وتحسين أساليب الكشف المبكر عن سرطان الغدة المعدية على مستوى العالم.
يُظهر سرطان المعدة استجابة جيدة للعلاجات الكيميائية السامة للخلايا، ويُعد العلاج الكيميائي المساعد التمهيدي (Neoadjuvant chemotherapy) فعّالًا في تحسين النتائج الجراحية اللاحقة. لذلك، يُنصح بأن يحصل معظم المرضى على علاج كيميائي تمهيدي قبل الجراحة، وهناك العديد من الأنظمة العلاجية التي تم فحصها بدقة في الدراسات السريرية. يحمل هذا النهج عدة مزايا نظرية، منها:
- تكامل العلاج المتعدد الوسائط بشكل أفضل.
- تقليص حجم المرض قبل الجراحة، مما يجعل العملية الجراحية أكثر فعالية وأقل تعقيدًا.
- العلاج المبكر للمرض النقيلي الدقيق، حيث يمكن معالجة الخلايا السرطانية التي انتشرت ولم تُكتشف بعد.
- القدرة على تقييم استجابة الورم للعلاج الكيميائي قبل الجراحة، مما يوفر فرصة لتكييف العلاج وفقاً لنتائج الاستجابة.
أظهرت الدراسات السريرية العشوائية في المملكة المتحدة تحسنًا واضحًا في معدل البقاء على قيد الحياة لدى المرضى الذين خضعوا للجراحة بالتزامن مع العلاج الكيميائي المحيط بالجراحة، مقارنةً بمن خضعوا للجراحة فقط. كان هذا التحسن ملحوظًا بشكل خاص في الحالات المتقدمة من الأورام، حيث أثبتت المعالجة الكيميائية المسبقة تأثيرًا إيجابيًا كبيرًا على النتائج.
أظهر المرضى الذين تلقوا العلاج الكيميائي أثناء الجراحة تحسنًا بنسبة 13% في معدل البقاء على قيد الحياة لمدة 5 سنوات مقارنةً بالجراحة وحدها، كما انخفض خطر الوفاة بنسبة 25%. هذه النتائج تؤكد فعالية التكامل بين الجراحة والعلاج الكيميائي. وأظهرت الدراسة أن نظامECF (الذي يتضمن 5-فلورويوراسيل، إبيروبيسين، وسيسبلاتين) كان فعالًا عند اقترانه بالجراحة، حيث أدى إلى تراجع في حجم الورم وتحسين نسبة البقاء بشكل عام للمرضى الذين يعانون من سرطانات غدية قابلة للجراحة في المعدة أو أسفل المريء. كما أظهرت الدراسة تحسنًا ملحوظًا في معدلات البقاء على قيد الحياة وتقليل احتمالية تفاقم المرض.(5)
فائدة العلاج الكيميائي التمهيدي:
- يمكن أن يعمل العلاج الكيميائي قبل الجراحة على تقليل حجم الورم بشكل فعال، مما قد يؤدي إلى تحويل الأورام غير القابلة للاستئصال إلى أورام قابلة للاستئصال وتحسين فرص تحقيق استئصال كامل (R0). هذا النهج مفيد لكل من المرضى الذين يعانون من مرض قابل للاستئصال بوضوح وأولئك الذين يعانون من أورام متقدمة محليًا وغير قابلة للاستئصال في البداية.(6)
- هذا النهج يمكن تطبيقه على المرضى الذين لديهم أورام قابلة للاستئصال وكذلك على المرضى الذين يعانون من أورام غير قابلة للاستئصال، ولكنها غير منتشرة.
- يستهدف العلاج الكيميائي قبل العلاج النقائل الدقيقة المحتملة في وقت مبكر من مسار العلاج، وهو أمر مفيد بشكل خاص للمرضى المعرضين لخطر كبير للإصابة بنقائل بعيدة. قد يساعد هذا النهج النظامي في القضاء على النقائل الخفية التي لا يمكن للجراحة وحدها معالجتها.
- يتحمل المرضى بشكل عام العلاج الكيميائي قبل الجراحة بشكل أفضل من العلاج الكيميائي بعد الجراحة، حيث تكون حالتهم الغذائية وأدائهم أفضل غالبًا قبل الجراحة الكبرى. يمكن أن يؤدي هذا إلى ارتفاع معدلات إكمال نظام العلاج الكيميائي الكامل.
خلاصة القول: أصبح استخدام العلاج الكيميائي قبل الجراحة أو أثناء الجراحة لسرطان المعدة القابل للاستئصال نهجًا قياسيًا في العديد من البلدان بسبب فوائده المثبتة في تقليل الورم وتحسين البقاء على قيد الحياة والاستهداف المبكر للنقائل الدقيقة. تدعم الأدلة من التجارب العشوائية المتعددة هذا النهج المتعدد الوسائط باعتباره متفوقًا على الجراحة وحدها للعديد من المرضى المصابين بسرطان المعدة المتقدم موضعياً.
توصيات:
تنظير البطن والغسالة البريتوانية: أصبح المنظار أداة قيمة في تصنيف سرطان المعدة، خاصة في المرضى الذين لديهم أورام كبيرة. وصار هذا الإجراء ضرورياً عند المرضى المصابين بأورام متقدّمة موضعياً لتحرّي وجود النقائل صغيرة الحجم في البريتوان والكبد والتي لا يمكن كشفها بالتصوير الطبقي المحوري. يفيد الغسيل البريتواني أيضاً لأن الدراسة الخلوية البريتوانية الإيجابية للخباثة تترافق مع إنذار سيء للغاية ومن النادر أن تكون الجراحة مفيدة في هذه الحالة ” يجب تأجيل الجراحة في المرضى الذين لديهم الغسالة البريتوانية إيجابية دون وجود نقائل بريتوانية واضحة”.(7)
مراقبة السرطان بعد العلاج:
إن مراقبة السرطان بعد العلاج من السرطان الغدي في المعدة أمر بالغ الأهمية لمراقبة تكرار المرض وإدارة المضاعفات وضمان الرفاهية العامة للمرضى. تلخص التوصيات التالية المبادئ التوجيهية الحالية لمتابعة ما بعد العلاج:(8)
- القصة السريرية والفحص البدني: يتم كل ثلاثة إلى ستة أشهر خلال أول سنة أو سنتين، ثم كل ستة إلى اثني عشر شهرًا خلال السنوات الثلاث إلى الخمس التالية.
- الفحوصات المخبرية: تعداد الدم الكامل واختبارات الكيمياء، ويتم إجراؤها حسب المؤشرات السريرية لمراقبة الصحة العامة واكتشاف أي تشوهات.
- نقص التغذية: مراقبة نقص الحديد ونقص فيتامين ب 12، وخاصة في المرضى الذين خضعوا لعلاج جراحي، مثل استئصال المعدة بالكامل. يجب تقديم العلاج حسب الحاجة.
- المراقبة بالمنظار: يجب إجراء تنظير الجهاز الهضمي العلوي بالنسبة للمرضى الذين خضعوا لاستئصال جزئي أو شبه كامل للمعدة، حسب المؤشرات السريرية. وهذا ضروري للكشف المبكر عن أي آفات أو مضاعفات جديدة.
- دراسات التصوير: يوصى بإجراء فحص التصوير المقطعي المحوسب للصدر والبطن والحوض مع الحقن كل ستة إلى اثني عشر شهرًا خلال العامين الأولين، ثم سنويًا لمدة تصل إلى خمس سنوات. ويساعد هذا في مراقبة أي علامات للتكرار أو النقائل.
- الدعم الغذائي: تؤكد الإرشادات المحدثة من الجمعية الأوروبية لعلم الأورام الطبي (ESMO) على المتابعة المنتظمة بعد العلاج والتي تتضمن الدعم الغذائي لتقييم نقص الفيتامينات والمعادن. وهذا مهم بشكل خاص نظرًا للتأثير المحتمل للتدخلات الجراحية على التغذية.(9)
اعتبارات إضافية
يجب أن تتضمن التقييمات المنتظمة أيضًا مناقشات حول العلاجات المحتملة المرتبطة بالسرطان إذا لزم الأمر، بناءً على التقييمات المستمرة لحالة المريض.
باختصار، تعد استراتيجية المراقبة الشاملة التي تتضمن التقييمات السريرية والاختبارات المعملية والتقييمات بالمنظار ودراسات التصوير والدعم الغذائي ضرورية لإدارة المرضى بشكل فعال بعد العلاج من سرطان الغدة المعدية. تهدف هذه التوصيات إلى تحسين الكشف المبكر عن التكرار وتعزيز جودة الحياة بشكل عام للناجين.
تنويه: تم إجراء هذا العمل الجراحي في مشفى إدلب الجراحي التخصصي المدعوم من الرابطة الطبية للمغتربين السوريين سيما من قبل الدكتور المقيم لدى الهيئة السورية للاختصاصات الطبية سبومز في اختصاص الجراحة العامة د. ياسين المسطو، تحت إشراف الدكتور زهير قراط اختصاصي الجراحة العامة.
المراجع:
1. Rawla P, Barsouk A. Epidemiology of gastric cancer: Global trends, risk factors and prevention. Vol. 14, Przeglad Gastroenterologiczny. 2019.
2. Wong MCS, Huang J, Chan PSF, Choi P, Qian Lao X, Chan SM, et al. Global incidence and mortality of gastric cancer, 1980-2018. JAMA Netw Open. 2021;4(7).
3. Ilic M, Ilic I. Epidemiology of stomach cancer. Vol. 28, World Journal of Gastroenterology. 2022.
4. Thuler LCS. The Epidemiology of Stomach Cancer. In: Gastrointestinal Cancers. 2022.
5. Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJH, Nicolson M, et al. Perioperative Chemotherapy versus Surgery Alone for Resectable Gastroesophageal Cancer. New England Journal of Medicine. 2006;355(1).
6. Mamon H, Enzinger PC. Adjuvant and neoadjuvant treatment OF GASTRIC CANCER. UpToDate. 2019;
7. Park E, Nishimura M, Simoes P. Endoscopic advances in the management of gastric cancer and premalignant gastric conditions. World J Gastrointest Endosc. 2023;15(3).
8. Aurello P, Petrucciani N, Antolino L, Giulitti D, D’Angelo F, Ramacciato G. Follow-up after curative resection for gastric cancer: Is it time to tailor it? Vol. 23, World Journal of Gastroenterology. 2017.
9. Lordick F, Carneiro F, Cascinu S, Fleitas T, Haustermans K, Piessen G, et al. Gastric cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology. 2022;33(10).